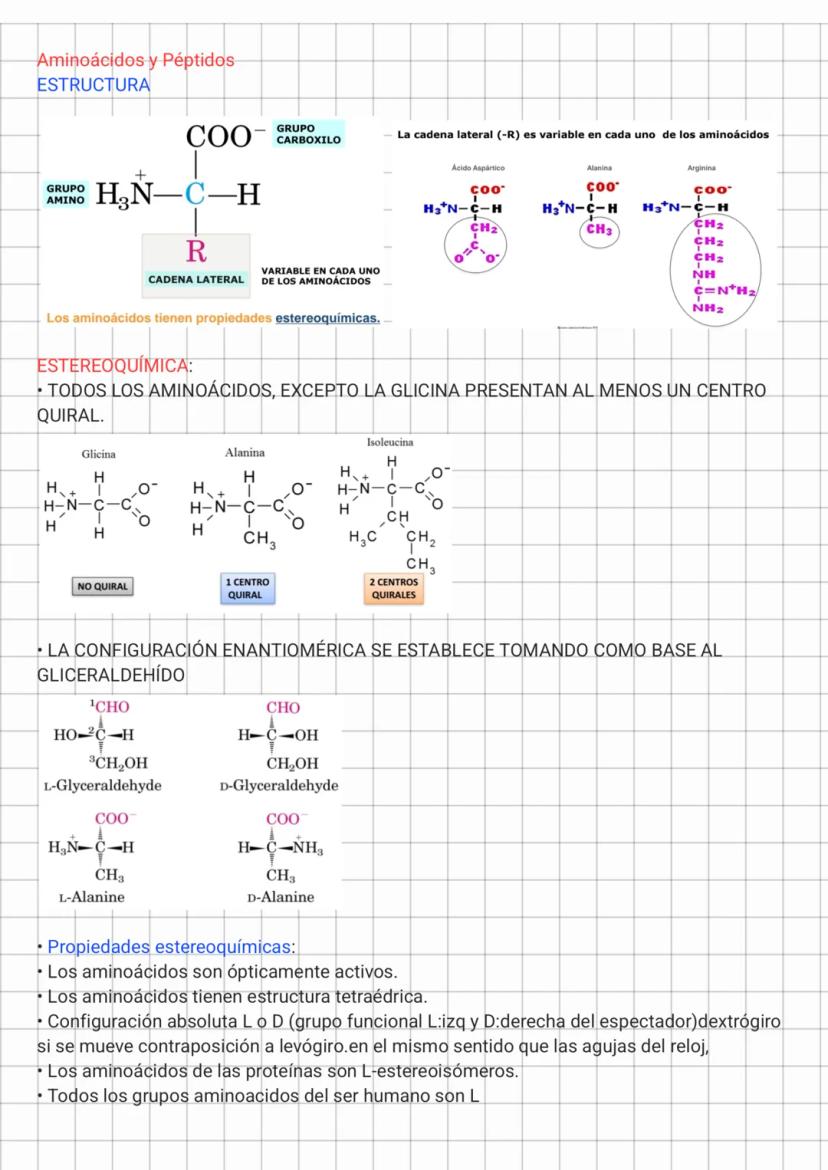
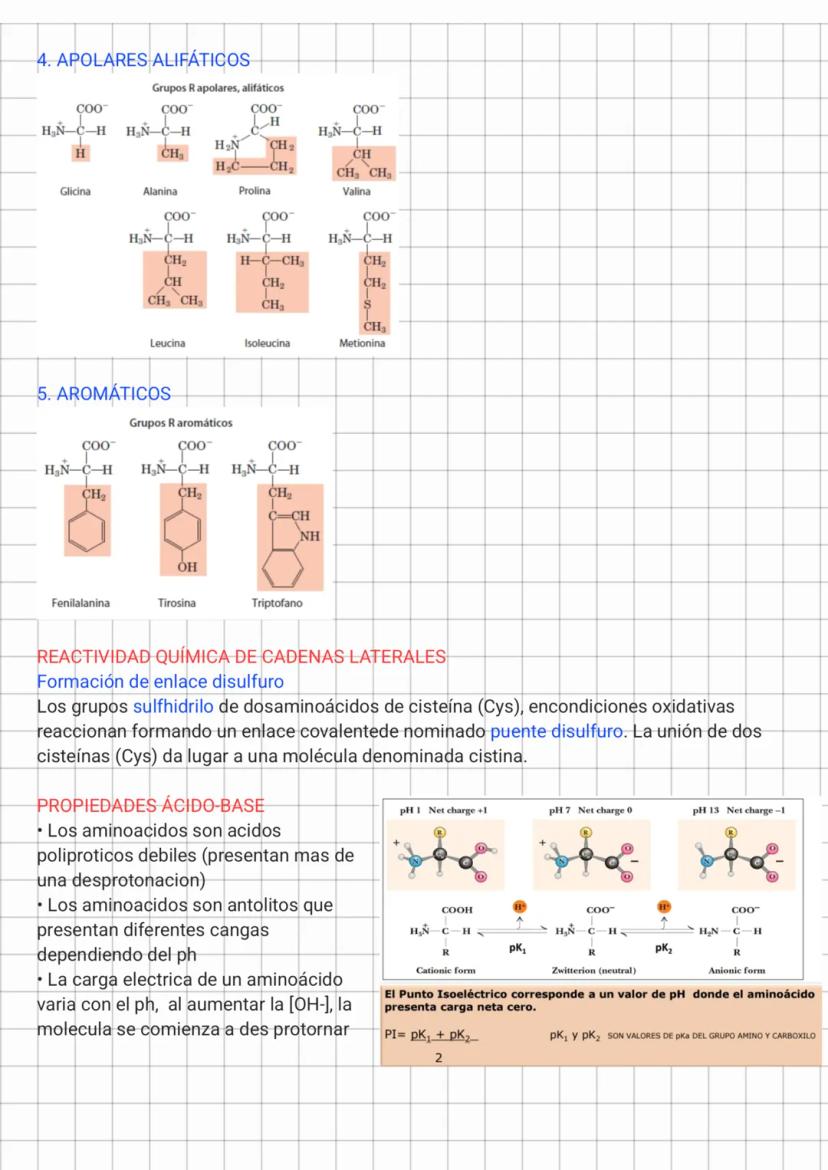
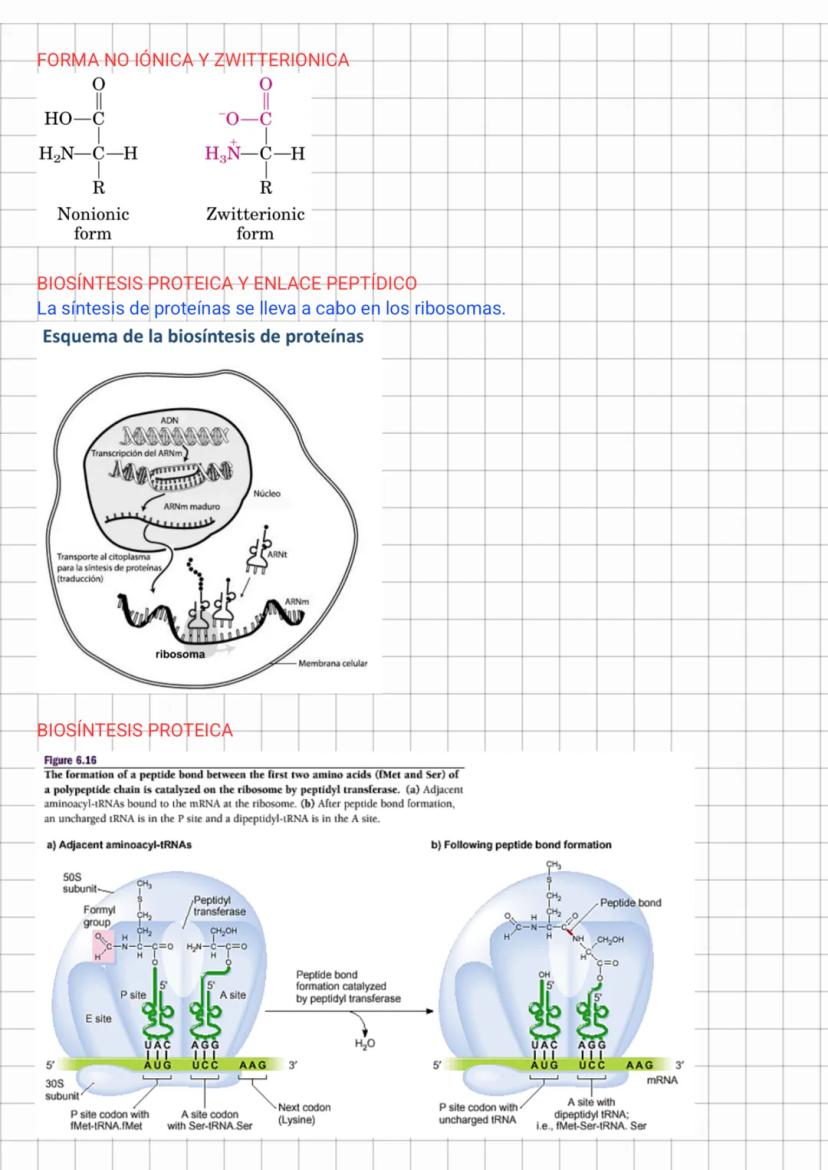
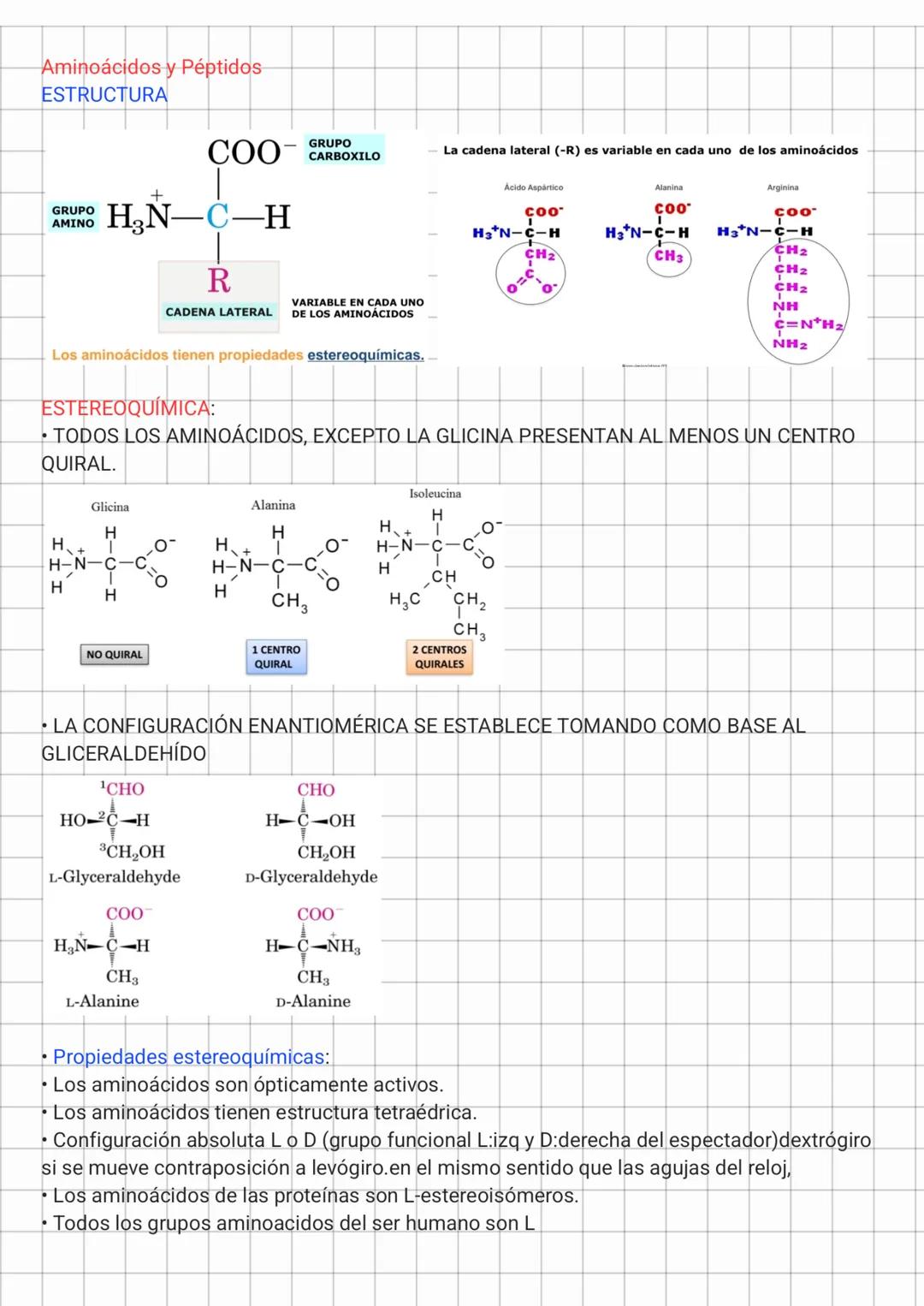
Aminoácidos Apolares y Propiedades Ácido-Base
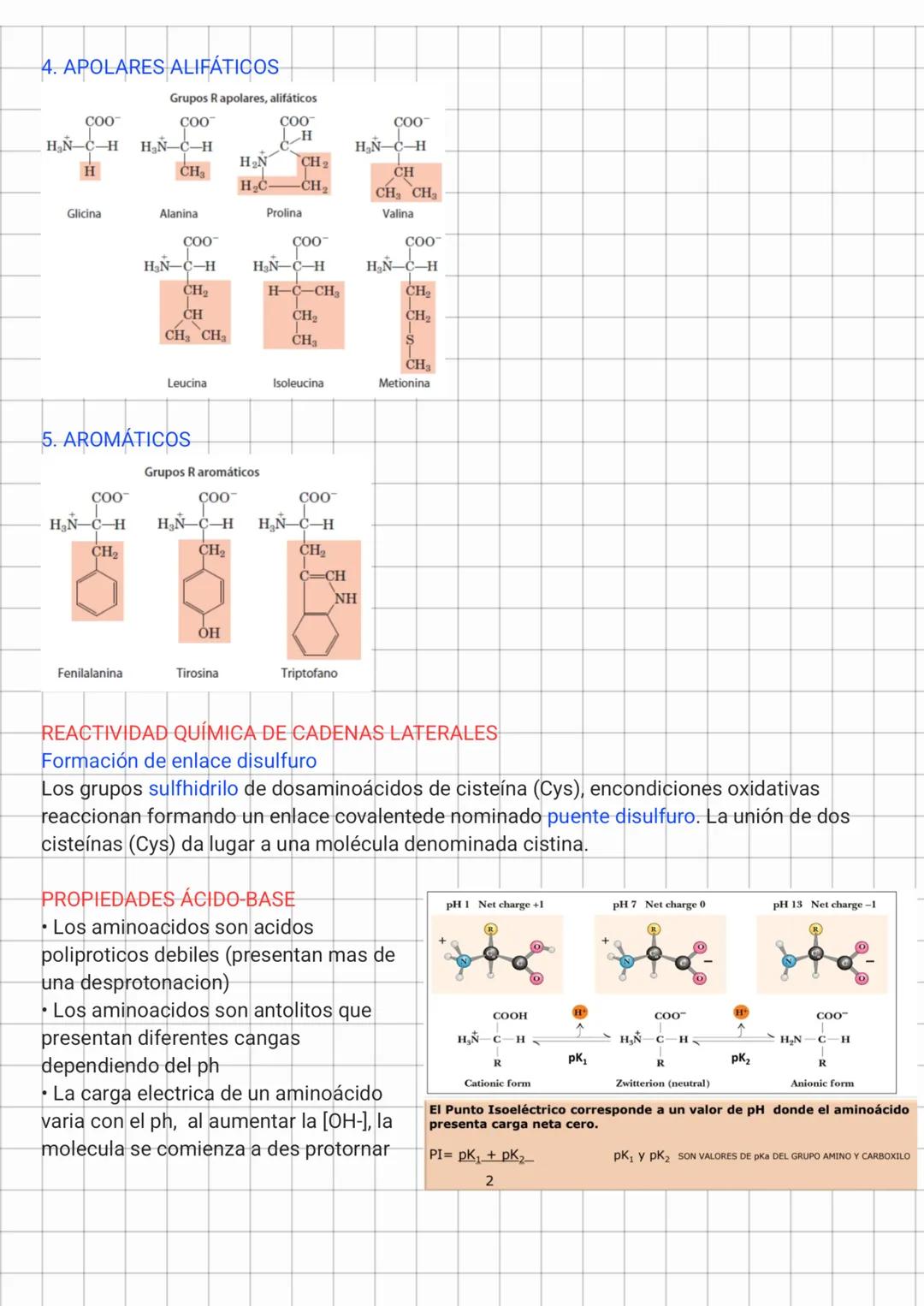
Los aminoácidos apolares alifáticos incluyen glicina, alanina, prolina, valina, leucina, isoleucina y metionina. Sus cadenas laterales son hidrofóbicas y tienden a agruparse en el interior de las proteínas, lejos del agua. Este efecto hidrofóbico es una de las principales fuerzas que estabilizan la estructura tridimensional de las proteínas.
Los aminoácidos aromáticos como fenilalanina, tirosina y triptófano contienen anillos aromáticos en sus cadenas laterales. Además de ser hidrofóbicos, pueden participar en interacciones π-π (apilamiento) que contribuyen a la estabilidad de las proteínas.
Una propiedad química importante es la capacidad de la cisteína para formar enlaces disulfuro mediante la oxidación de sus grupos sulfhidrilo, creando un puente covalente llamado cistina. Estos enlaces son cruciales para estabilizar la estructura terciaria de muchas proteínas.
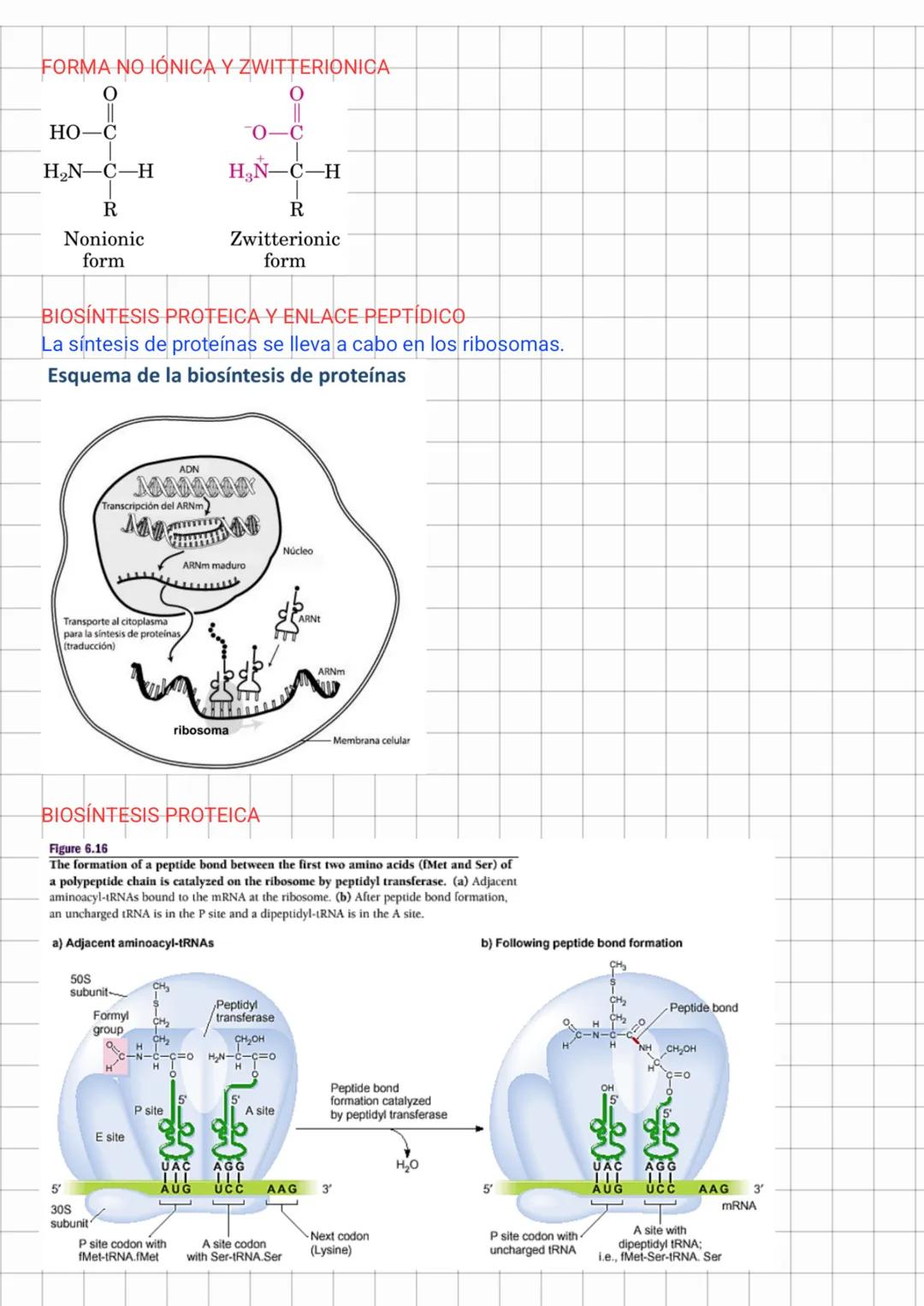
Los aminoácidos son ácidos polipróticos débiles cuya carga neta varía con el pH. A pH bajo están cargados positivamente, a pH alto negativamente, y a un pH específico llamado punto isoeléctrico (pI), tienen carga neta cero (forma zwitteriónica). El pI se calcula como el promedio de los valores pKa de los grupos ionizables.
🧪 El punto isoeléctrico (pI) es fundamental en técnicas de laboratorio como la electroforesis, donde las proteínas migran según su carga. ¡A su pI, las proteínas no migran porque tienen carga neta cero!