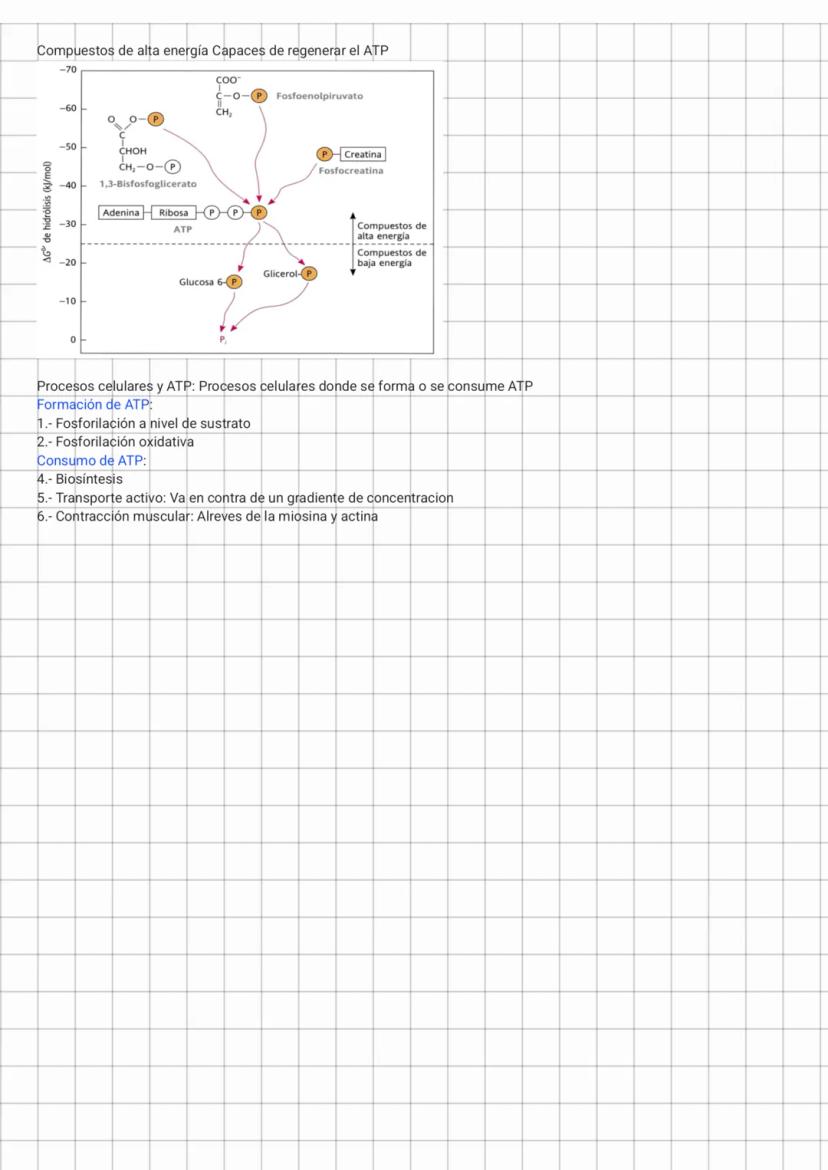
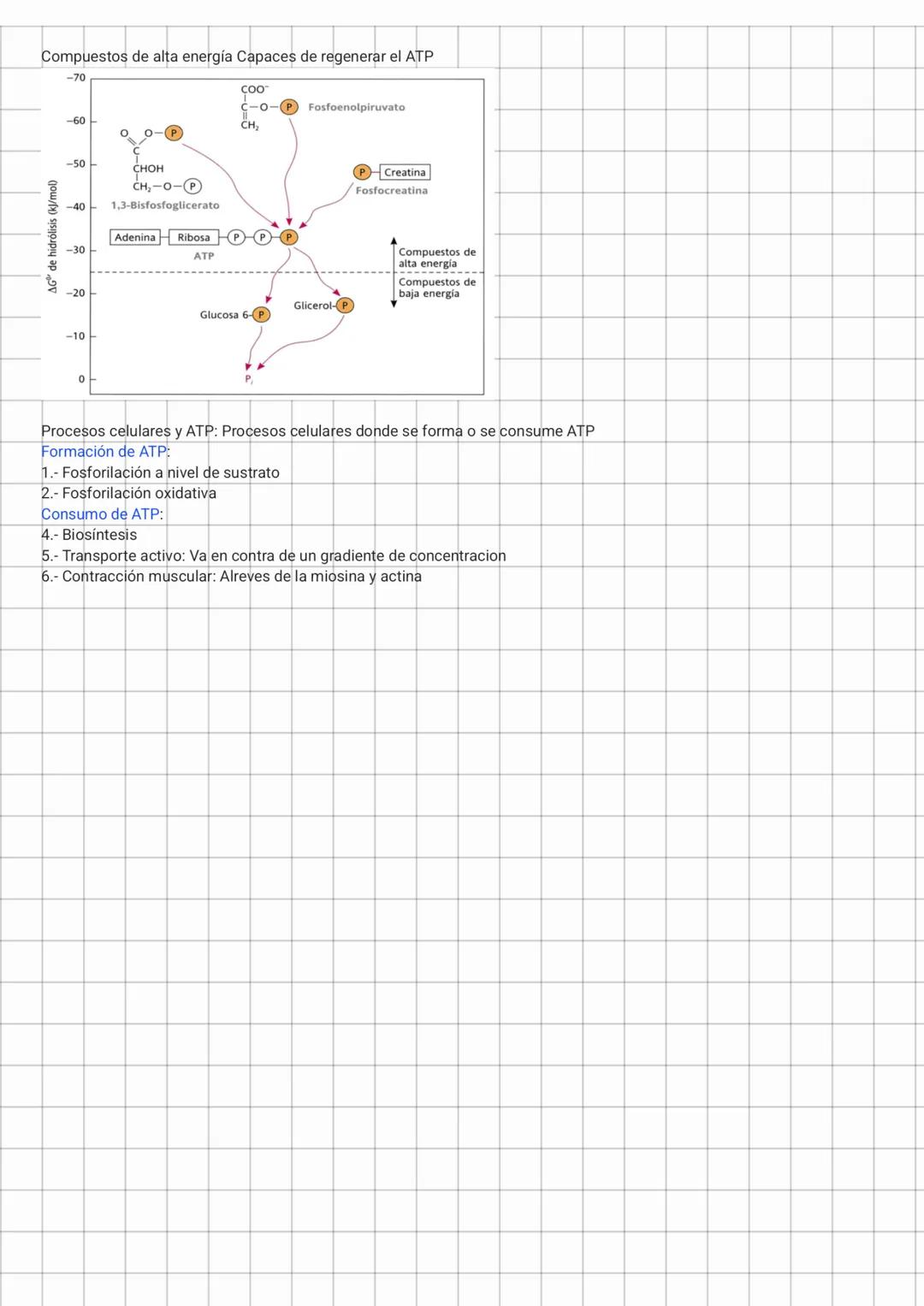
Acoplamiento energético y ATP
¿Cómo ocurren reacciones que requieren energía en los sistemas biológicos? La respuesta está en el acoplamiento energético. Una reacción endergónica (ΔG positivo) puede ocurrir cuando se acopla a una reacción exergónica (ΔG negativo), siempre que la suma total de energía libre sea negativa.
El ATP (adenosín trifosfato) es la molécula clave en este proceso, funcionando como el principal "nexo energético" en las células. Al romper los enlaces de fosfoanhídrido del ATP, se libera energía ΔG=−7,3Kcal/mol que puede impulsar reacciones endergónicas. Esto convierte al ATP en la "moneda energética" universal de los seres vivos.
Por ejemplo, la síntesis de glucosa-6-fosfato por sí sola es endergónica ΔG°=13,8kJ/mol, pero cuando se acopla a la hidrólisis del ATP ΔG°=−30,5kJ/mol, la reacción global se vuelve exergónica ΔG°=−16,7kJ/mol y por lo tanto, espontánea.
💡 Dato clave: La relación entre la constante de equilibrio (Keq) y ΔG° te indica inmediatamente si una reacción ocurrirá espontáneamente: Keq > 1 significa ΔG° negativo, lo que garantiza una reacción espontánea. Nunca encontrarás una Keq negativa o igual a cero.