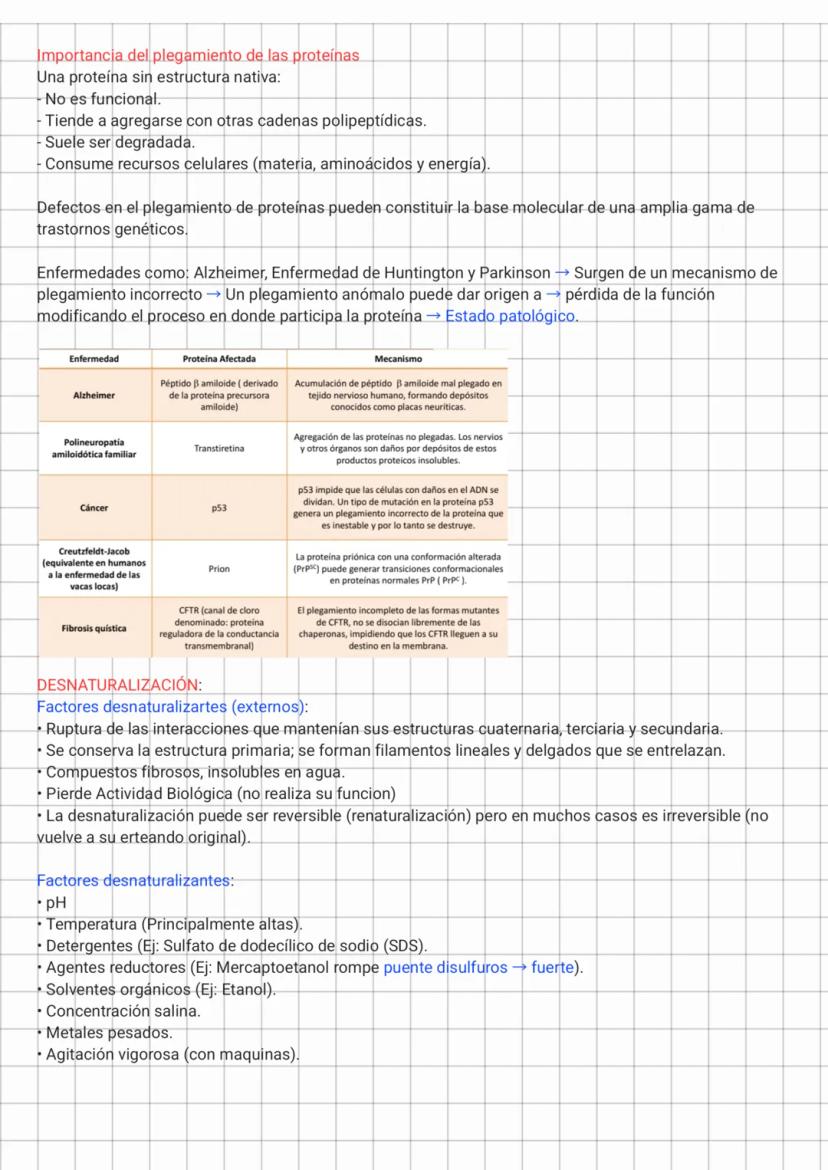
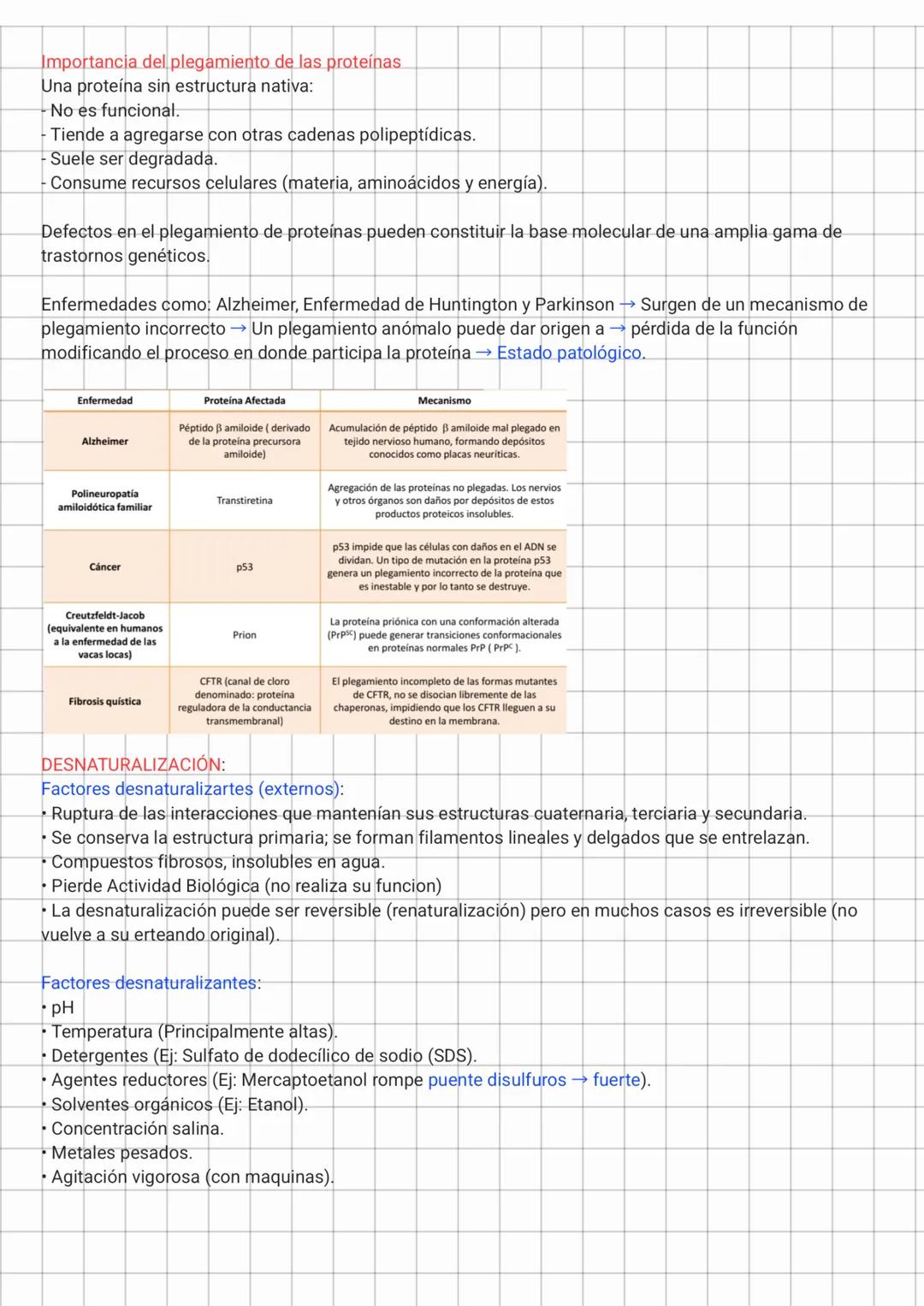
Análisis de Estructuras Proteicas
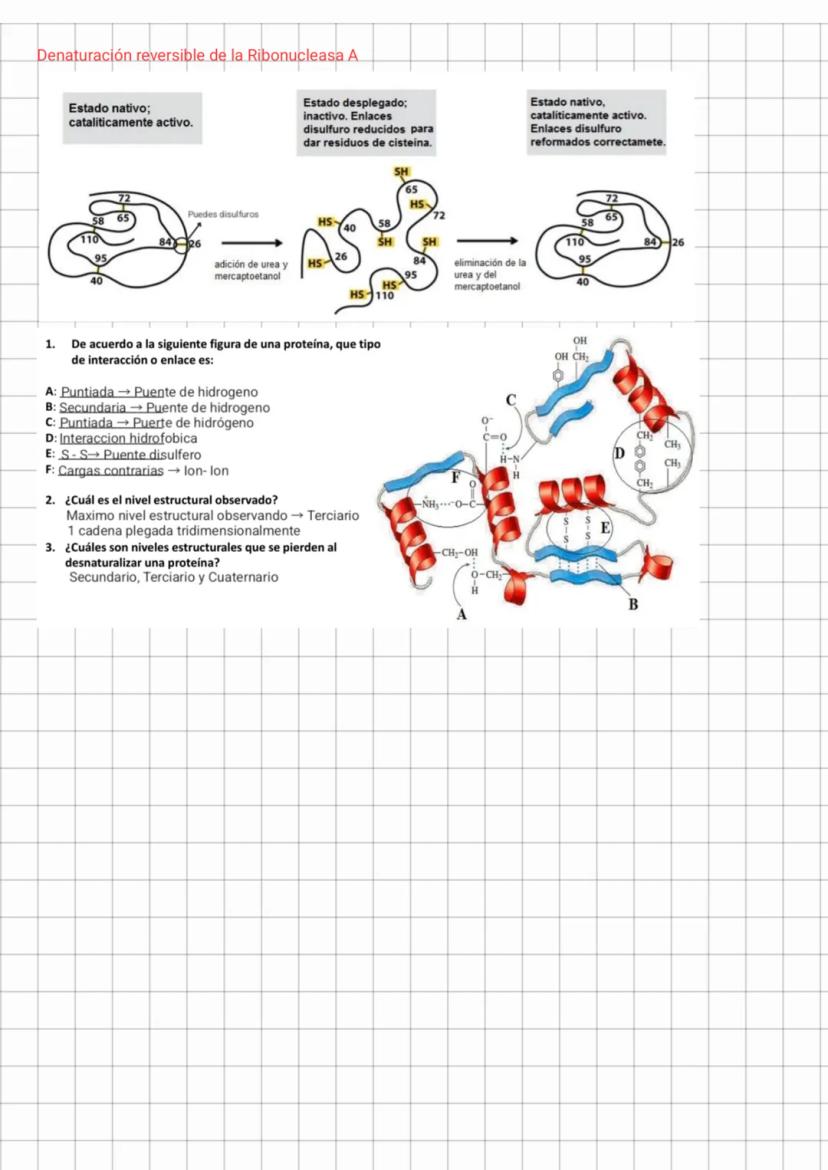
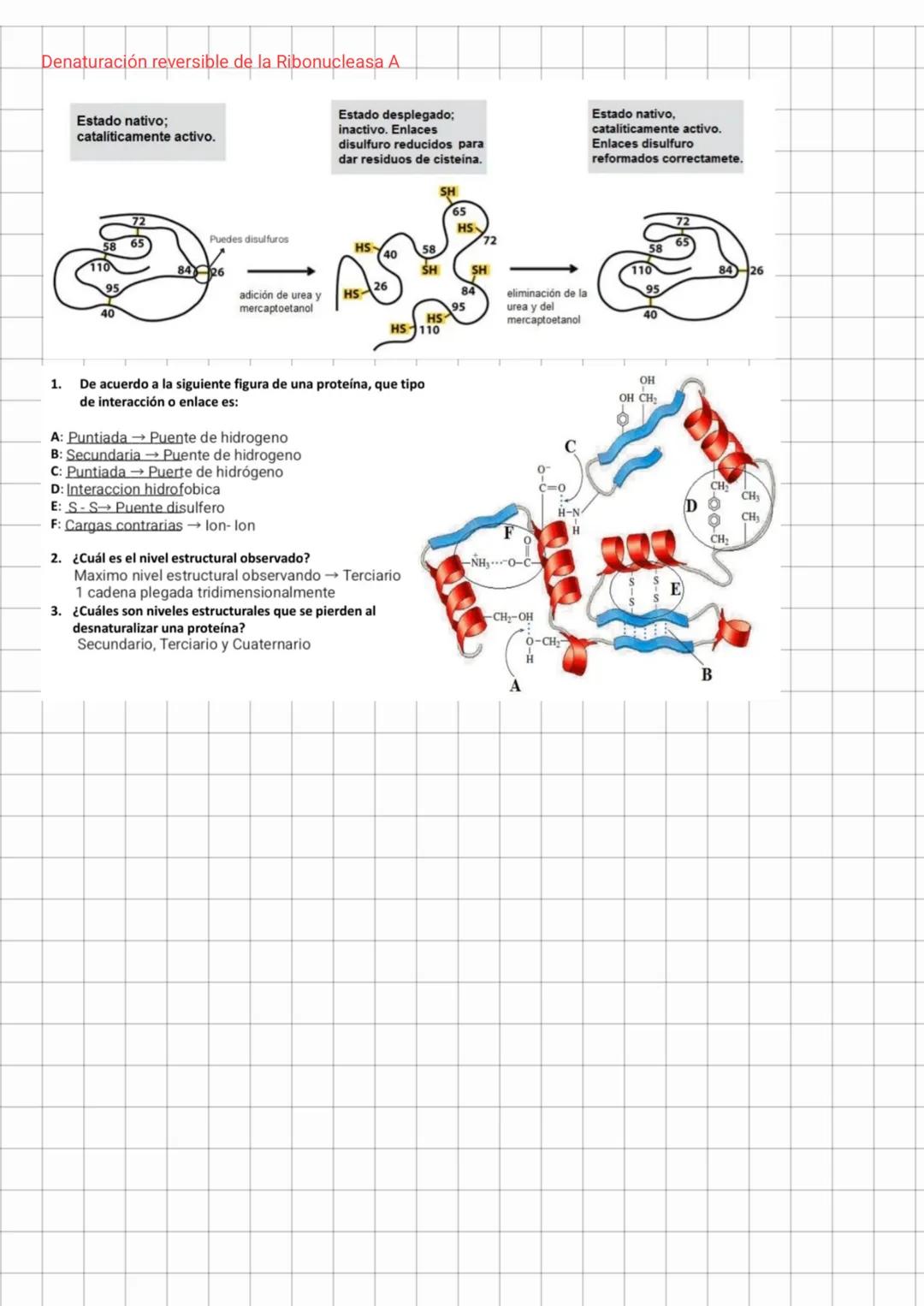
Cuando analizamos una proteína, podemos identificar distintos tipos de interacciones que la estabilizan. Por ejemplo, en una estructura proteica típica encontramos:
- Puentes de hidrógeno (interacciones puntuadas)
- Interacciones hidrofóbicas entre grupos no polares
- Puentes disulfuro enlacesS−S que son uniones covalentes fuertes
- Interacciones iónicas entre cargas opuestas
La ribonucleasa A es un excelente ejemplo de cómo una proteína puede desnaturalizarse y recuperar su estructura. Cuando se trata con urea y mercaptoetanol, sus puentes disulfuro se rompen y la estructura se despliega completamente, perdiendo su actividad catalítica. Sin embargo, al eliminar estos agentes desnaturalizantes, la proteína puede replegar correctamente y recuperar su actividad.
Al desnaturalizar una proteína, los niveles estructurales que se pierden son el secundario, terciario y cuaternario. La estructura primaria permanece intacta a menos que ocurra una proteólisis (ruptura de enlaces peptídicos).
🧪 Experimento interesante: Si calientas clara de huevo (proteína albúmina), observarás cómo pasa de transparente a blanca sólida. Esto ocurre porque las proteínas se desnaturalizan y exponen sus regiones hidrofóbicas, que interactúan entre sí formando agregados insolubles. ¡Este proceso es irreversible!