Número Cuántico Magnético (m)
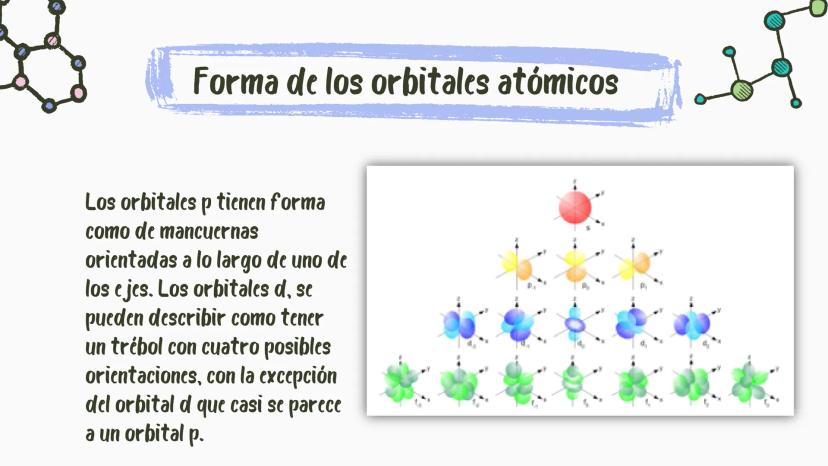
El número cuántico magnético (m) nos indica la orientación del orbital en el espacio. Es como saber en qué dirección apunta el orbital dentro del átomo.
Los valores posibles para m van desde -l hasta +l, pasando por cero. Por ejemplo, si l=1 (orbital p), entonces m puede ser -1, 0 o +1, lo que corresponde a los tres orbitales: px, py y pz.
Esta orientación es importante porque determina cómo los orbitales interactúan con campos magnéticos y cómo participan en los enlaces químicos.
💡 Visualízalo así: Si l=2 (orbital d), tendrás cinco posibles orientaciones m=−2,−1,0,+1,+2. Es como tener cinco formas distintas en que puede estar orientado el mismo tipo de orbital.