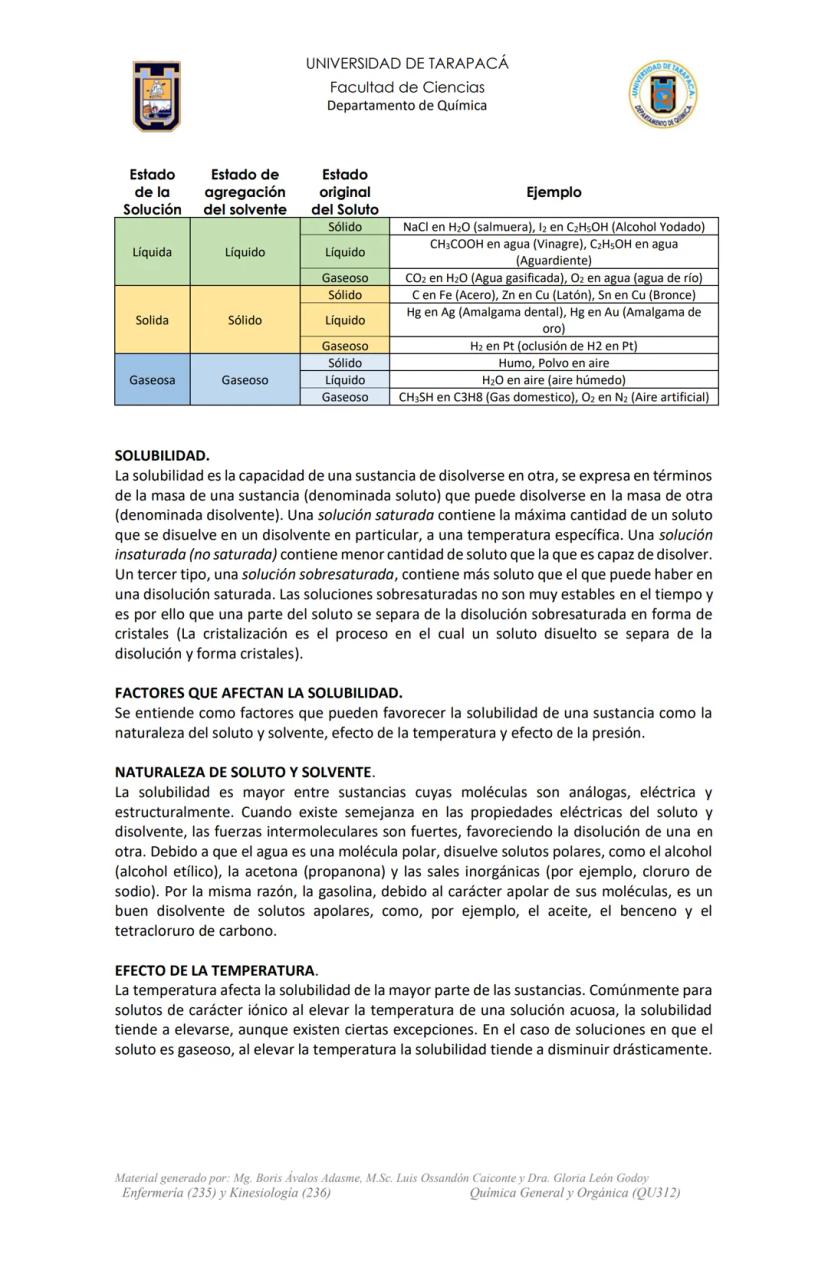
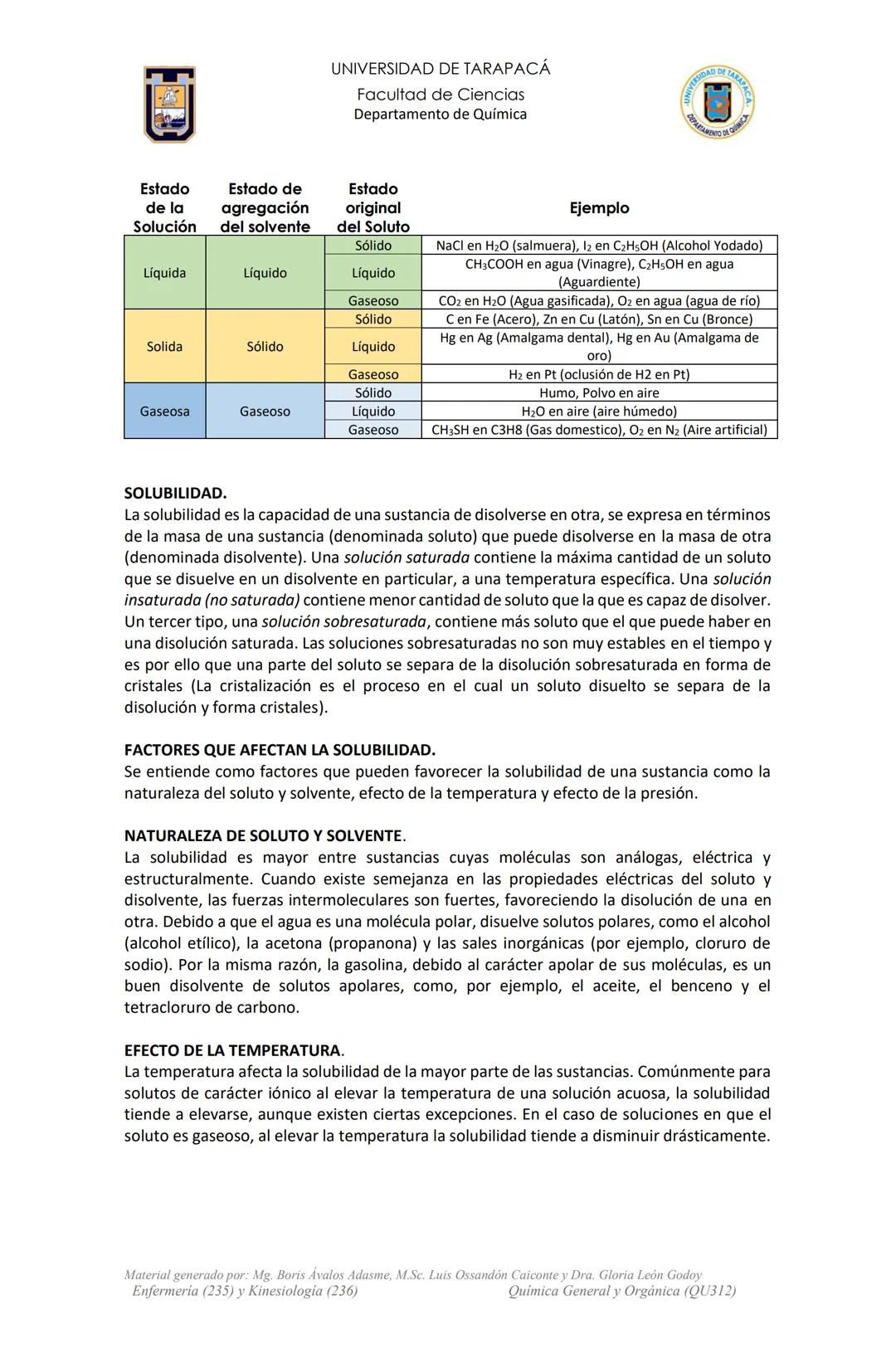
Unidades de Concentración: Molaridad y Osmolaridad
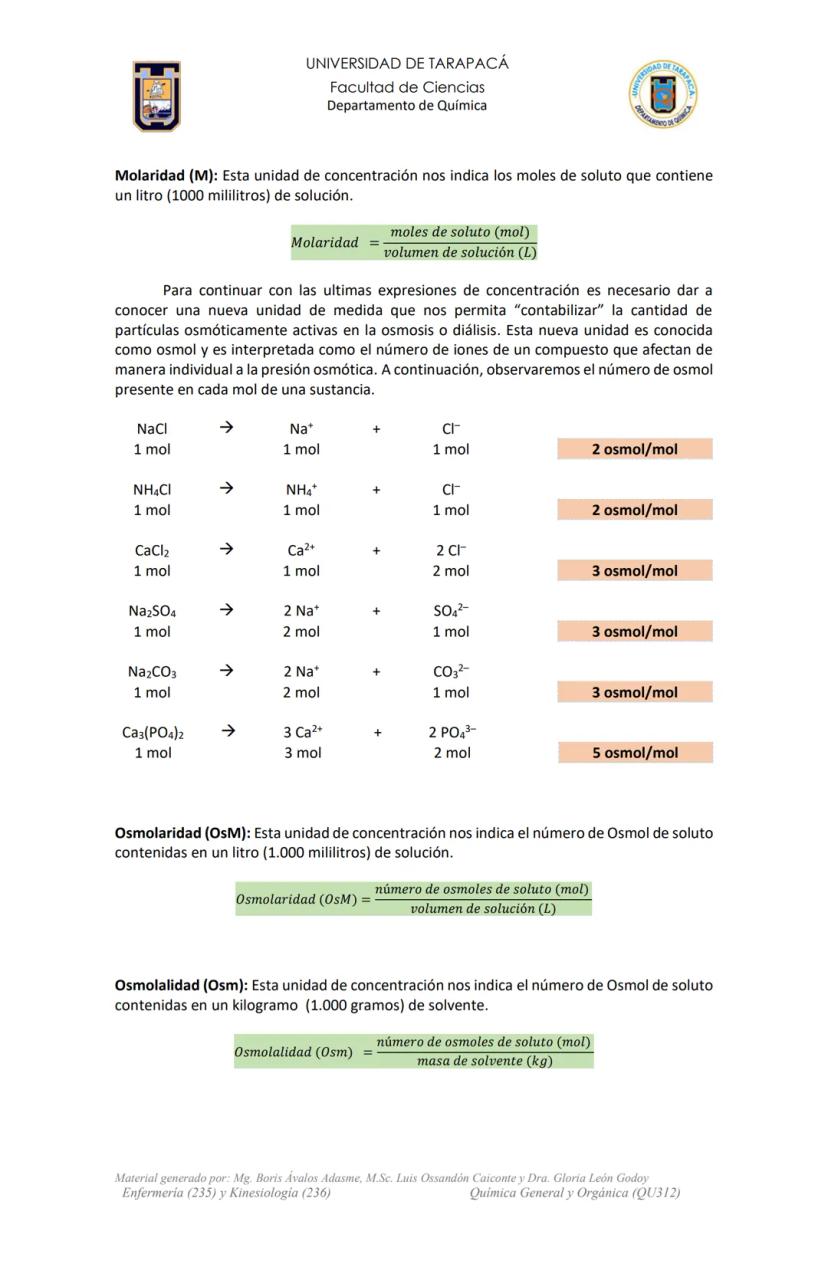
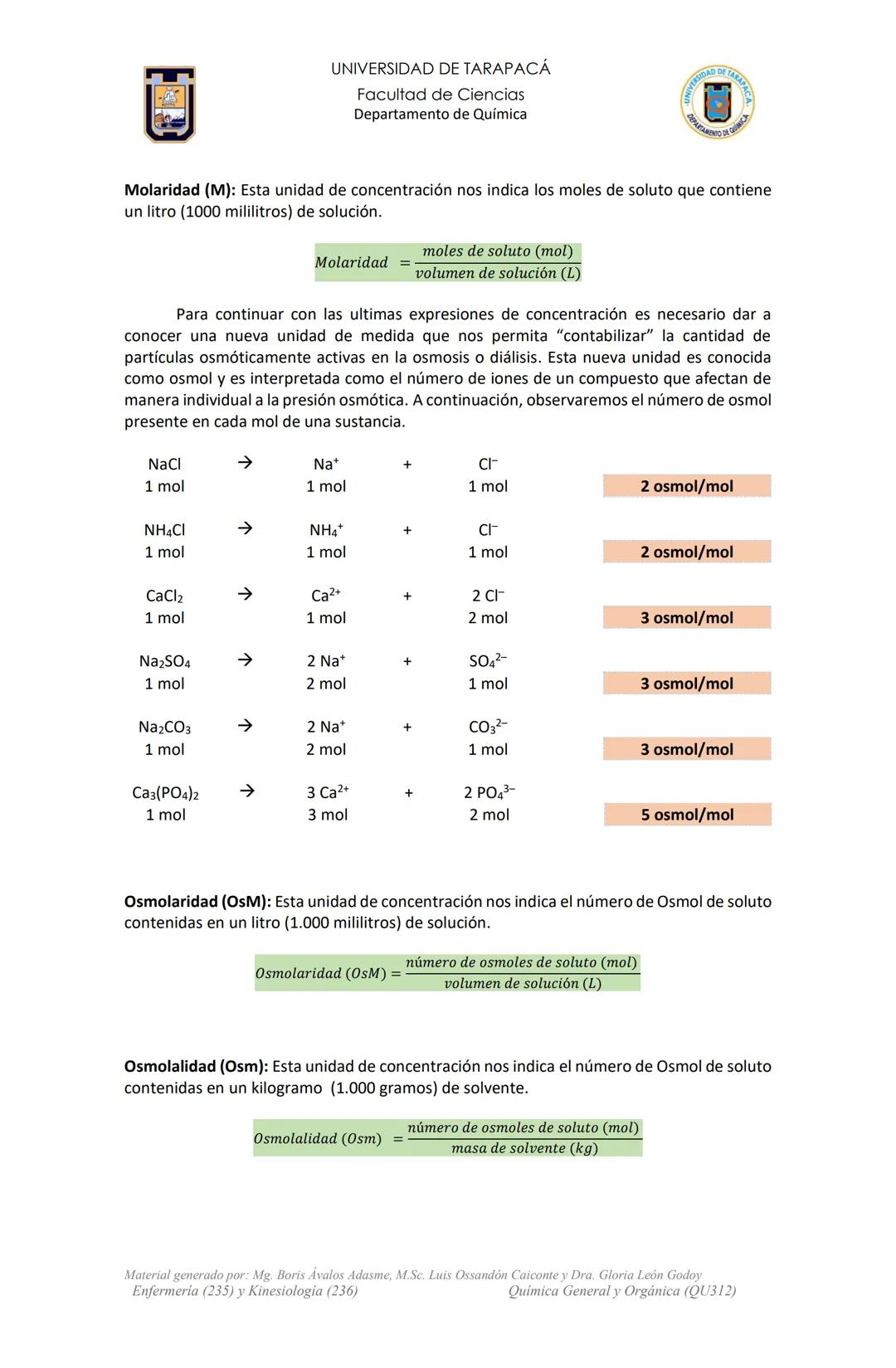
Molaridad (M)
Esta unidad química indica los moles de soluto que contiene un litro (1000 mL) de solución.
Molaridad=volumen de solucioˊn (L)moles de soluto (mol)
Por ejemplo, una solución 2 M de NaCl contiene 2 moles de NaCl por cada litro de solución.
Osmol y partículas osmóticamente activas
Un osmol es la unidad que mide las partículas que afectan individualmente la presión osmótica. Es fundamental en diálisis y terapias con fluidos.
Cuando un compuesto se disuelve, puede separarse en iones:
- NaCl → Na⁺ + Cl⁻ (1 mol genera 2 osmol)
- CaCl₂ → Ca²⁺ + 2Cl⁻ (1 mol genera 3 osmol)
Osmolaridad (OsM)
Indica el número de osmoles de soluto contenidos en un litro de solución.
Osmolaridad (OsM)=volumen de solucioˊn (L)nuˊmero de osmoles de soluto
Osmolalidad (Osm)
Indica el número de osmoles de soluto contenidos en un kilogramo de disolvente.
Osmolalidad (Osm)=masa de solvente (kg)nuˊmero de osmoles de soluto
💡 En el cuerpo humano, mantener la osmolaridad correcta es vital. Las soluciones intravenosas como el suero fisiológico están formuladas para tener una osmolaridad similar a la de la sangre 290mOsm/L, siendo isotónicas.
Estas unidades son especialmente importantes en medicina para evitar problemas como la hemólisis o crenación de células sanguíneas al administrar soluciones.