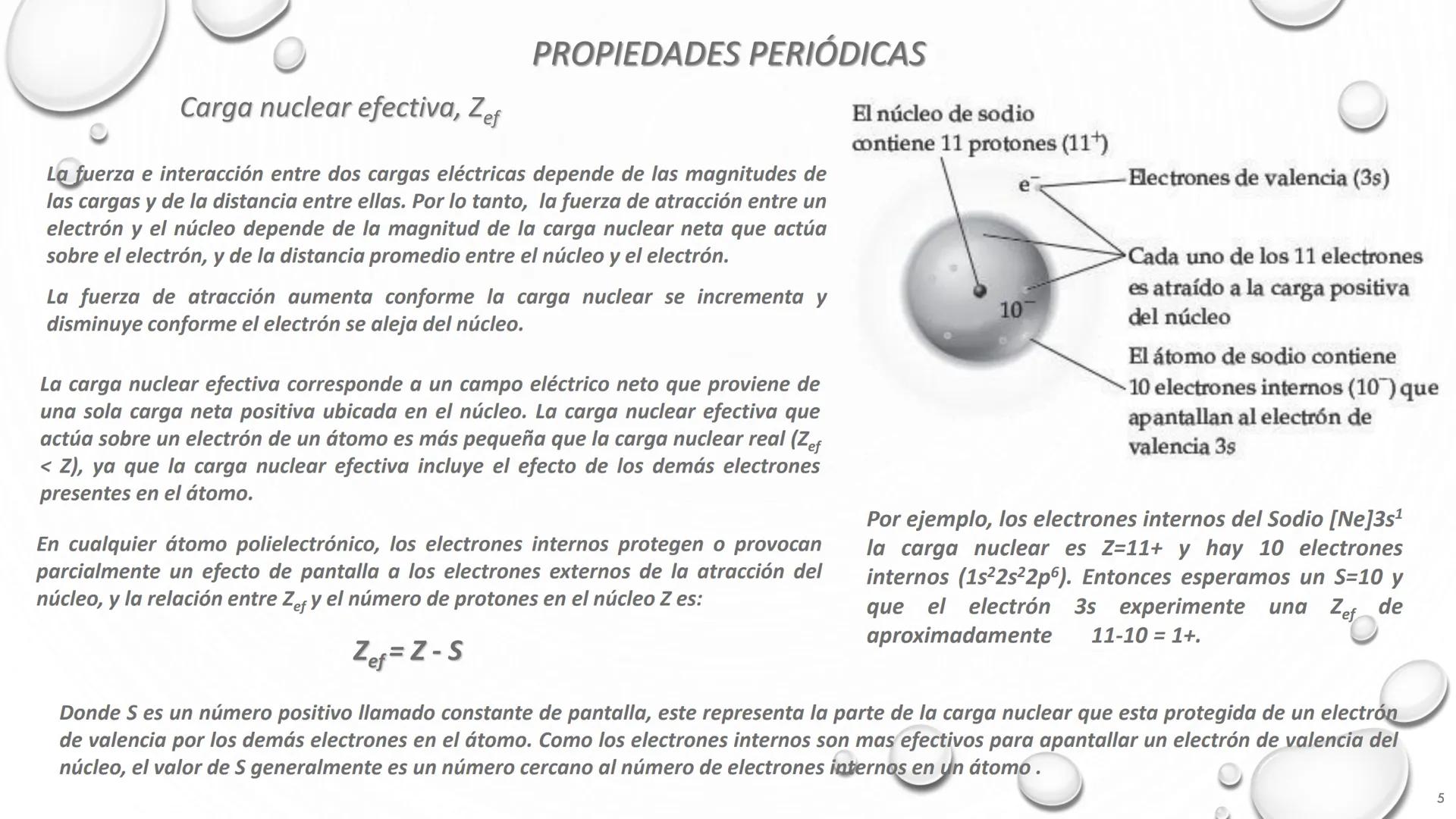
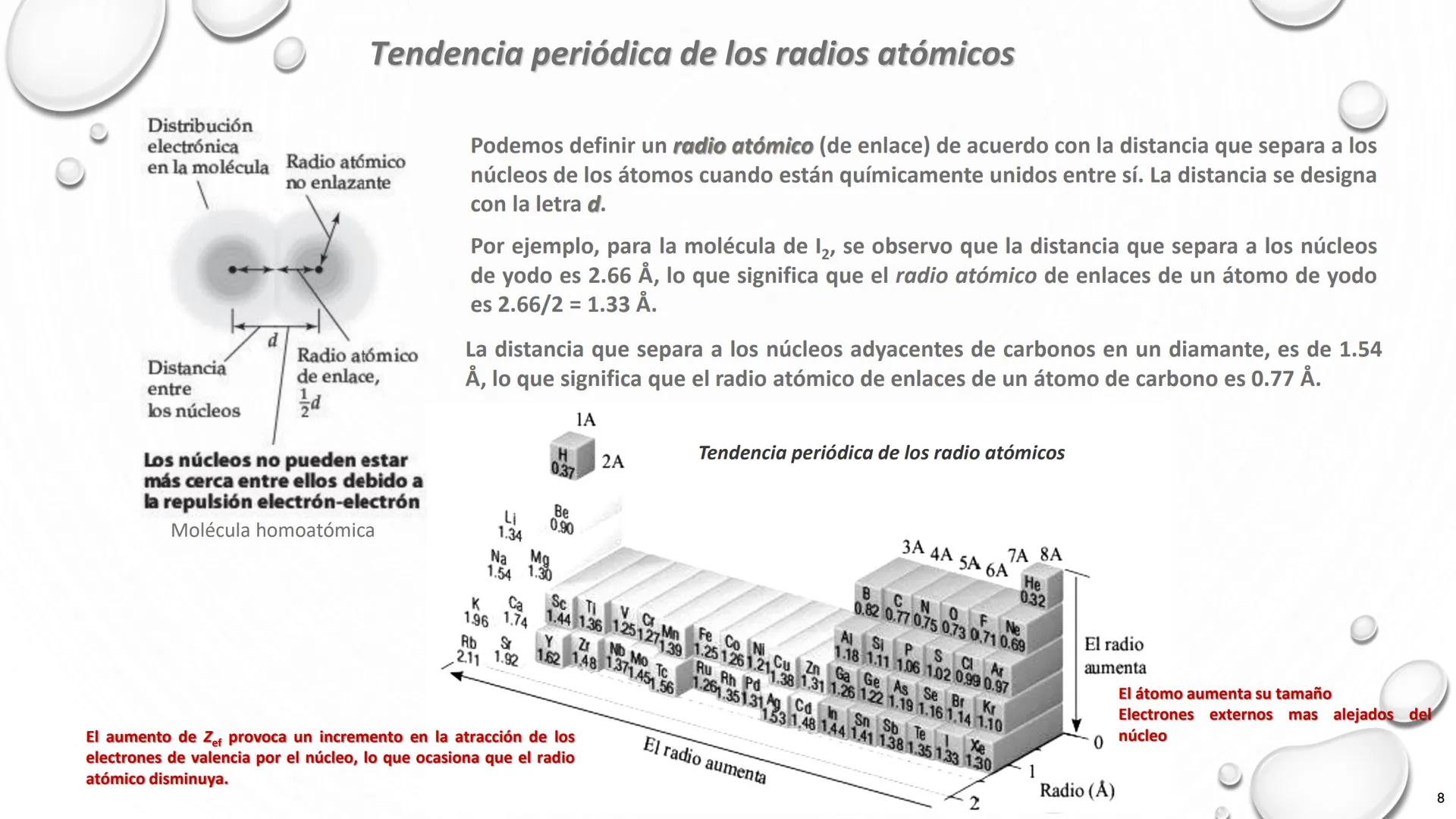
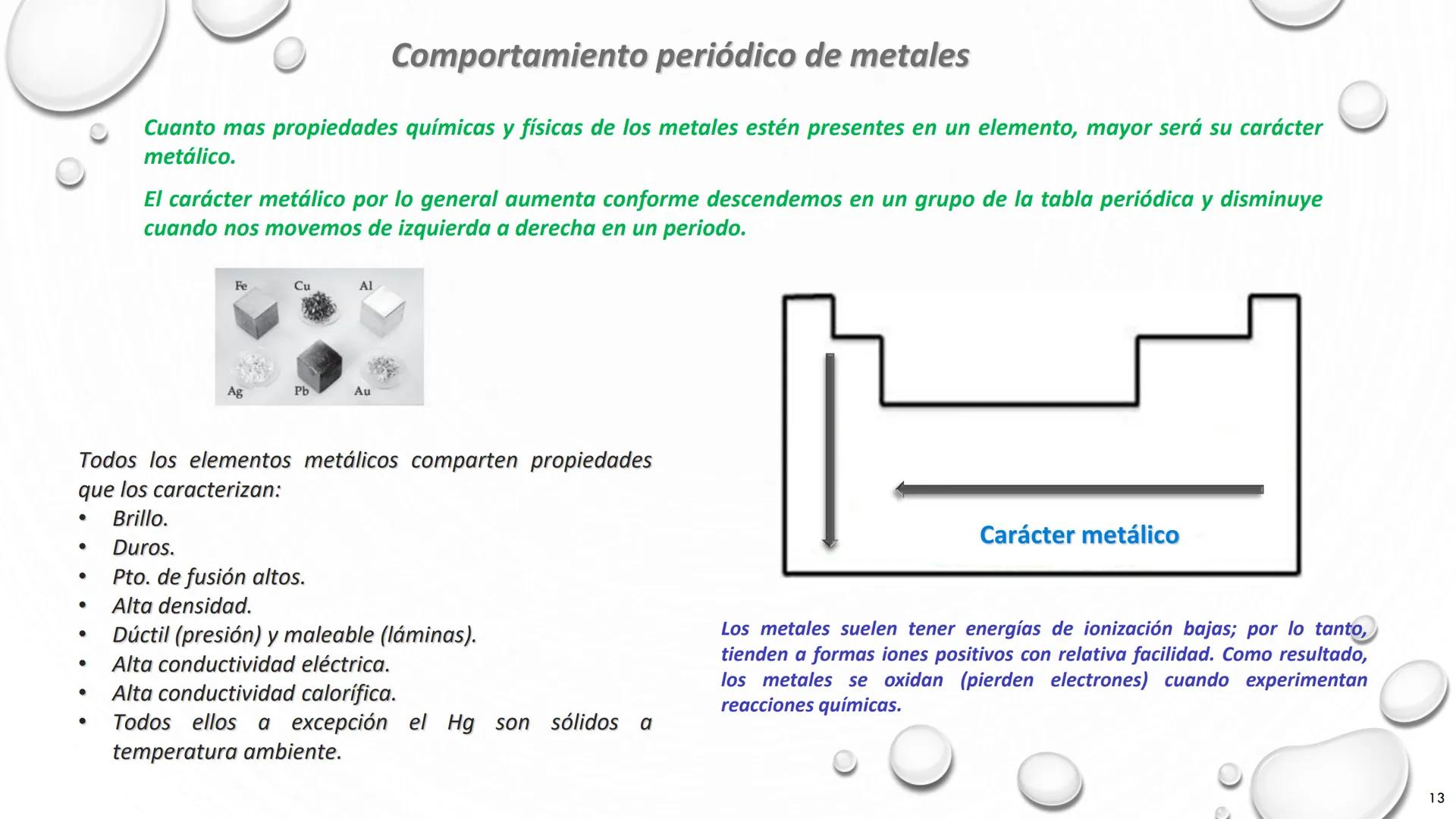
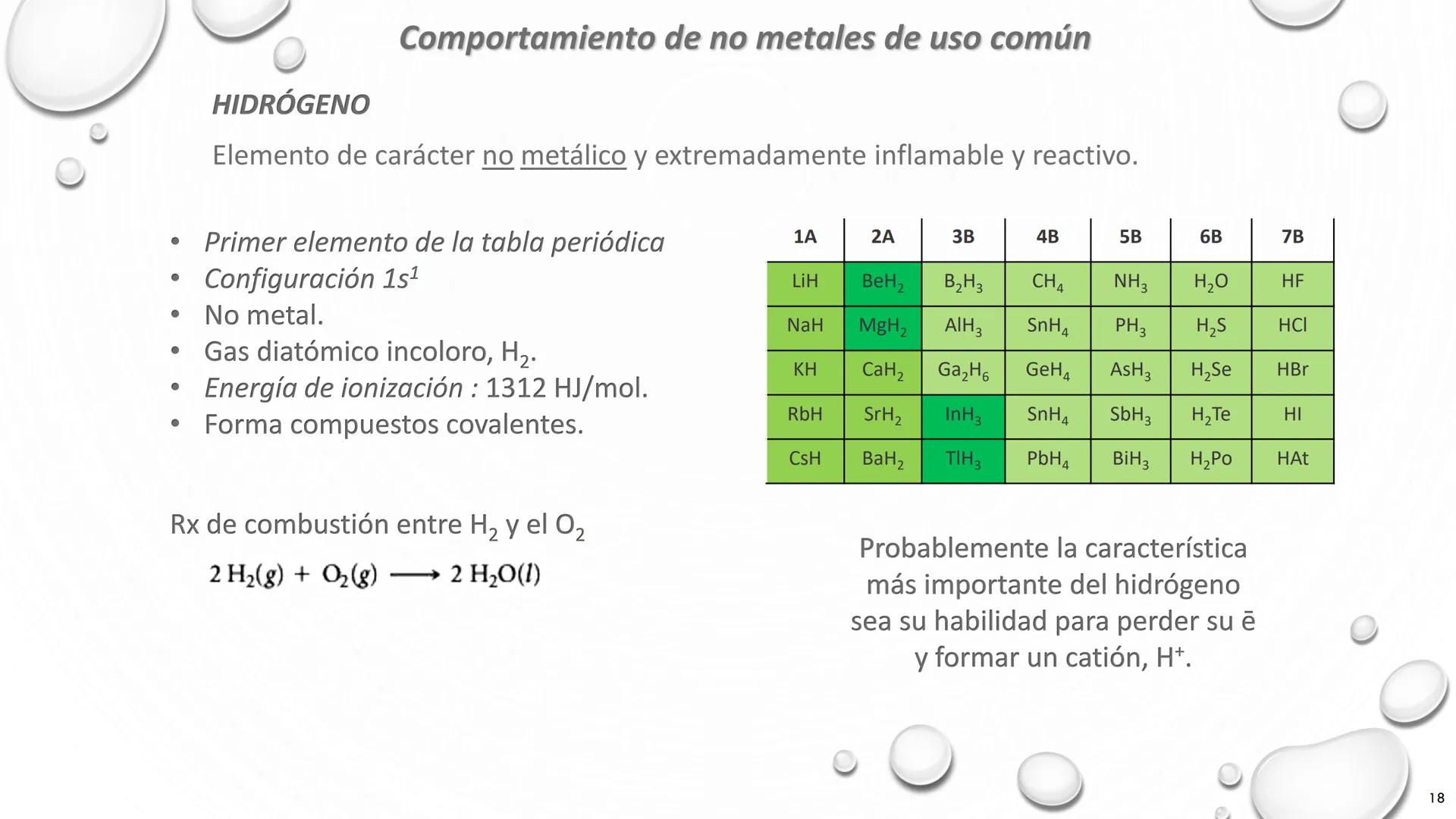
Nombre de Algunos Grupos de la Tabla Periódica
La tabla periódica se organiza en grupos (columnas) y períodos (filas), donde cada grupo comparte propiedades químicas similares:
Grupo 1A (Metales alcalinos): Li, Na, K, Rb, Cs, Fr
Son metales muy reactivos que forman compuestos iónicos con facilidad.
Grupo 2A (Metales alcalinotérreos): Be, Mg, Ca, Sr, Ba, Ra
Menos reactivos que los alcalinos, pero forman fácilmente iones con carga +2.
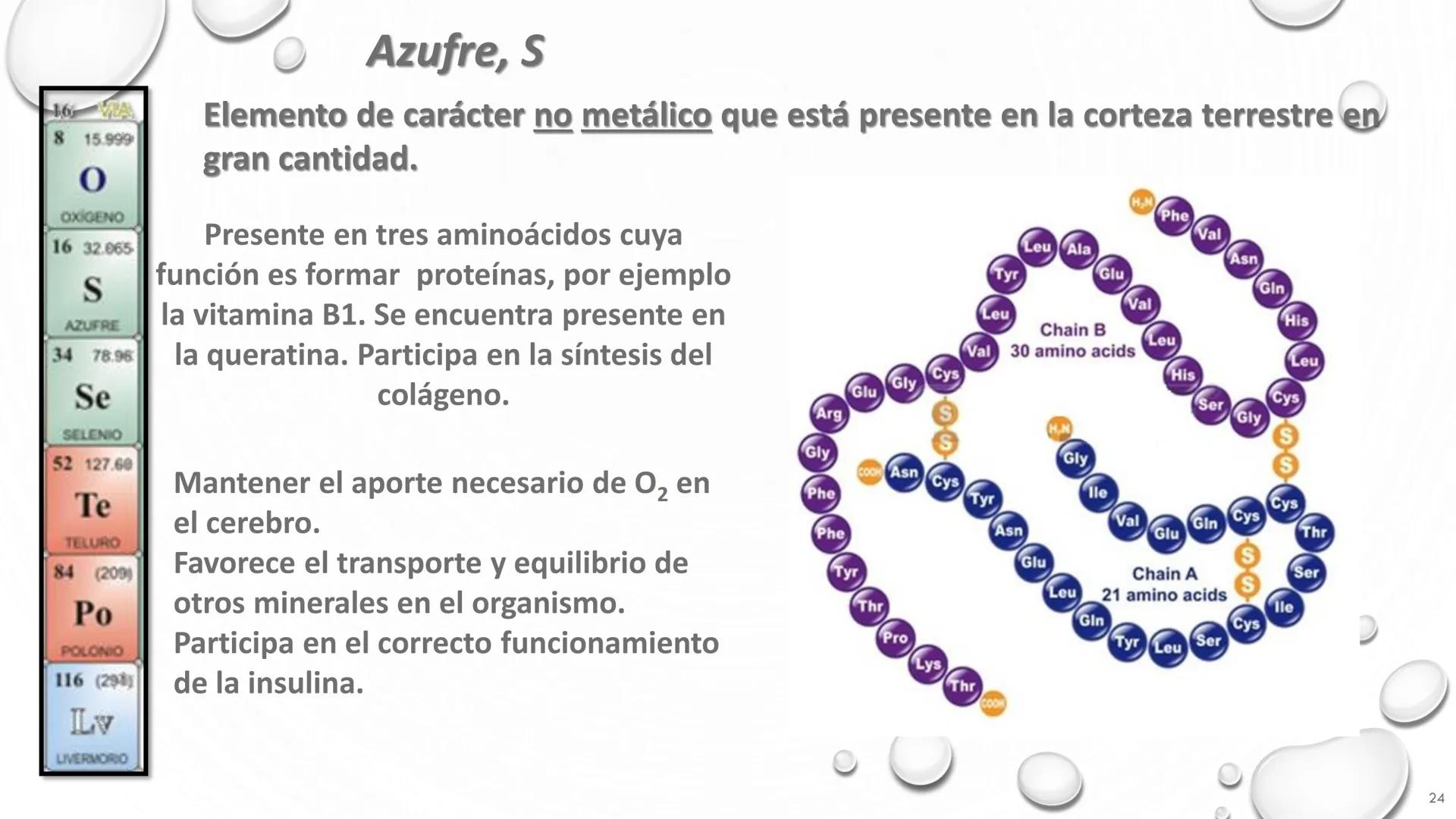
Grupo 6A (Calcógenos): O, S, Se, Te, Po
El oxígeno es esencial para la respiración, mientras el azufre es importante en proteínas.
Grupo 7A (Halógenos): F, Cl, Br, I, At
Elementos no metálicos muy reactivos que forman sales al combinarse con metales.
Grupo 8A (Gases nobles): He, Ne, Ar, Kr, Xe, Rn
Son estables y poco reactivos debido a su configuración electrónica completa.
🔍 Los metales están separados de los no metales por una línea escalonada que va desde el boro (B) hasta el astato (At). Esta frontera marca diferencias importantes en propiedades físicas y químicas.