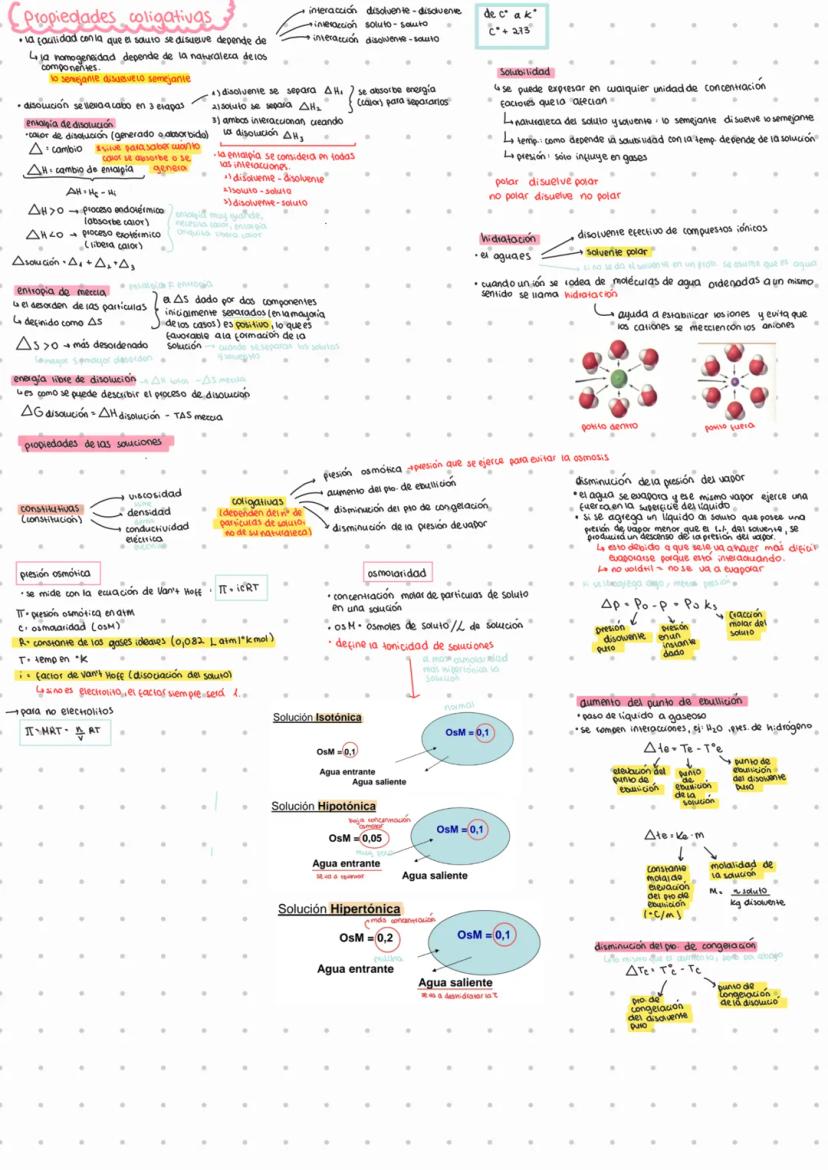
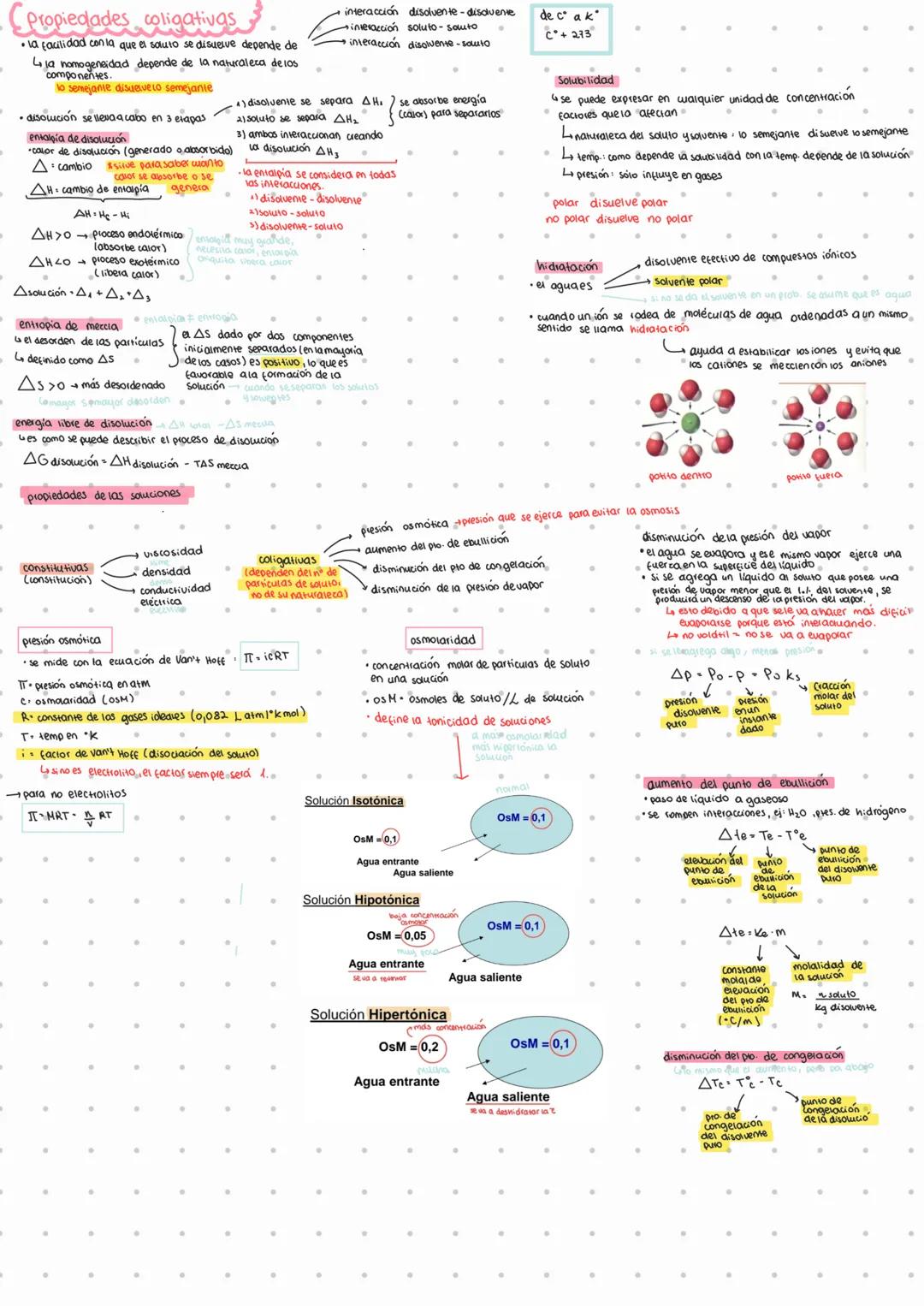
Propiedades Coligativas y Disoluciones
La disolución es un proceso que ocurre en tres etapas importantes, cada una con su propio cambio energético. Primero, las moléculas del disolvente se separan (ΔH₁), luego las del soluto (ΔH₂), y finalmente ambos interaccionan (ΔH₃). El cambio total de entalpía se expresa como: ΔH = ΔH₁ + ΔH₂ + ΔH₃.
La solubilidad sigue el principio de "semejante disuelve semejante". Esto significa que los compuestos polares (como el agua) disuelven sustancias polares, mientras que los no polares disuelven sustancias no polares. En el caso del agua, cuando rodea a iones formando estructuras ordenadas, se produce la hidratación, que estabiliza los iones y evita que los de cargas opuestas se atraigan.
Las propiedades coligativas dependen exclusivamente del número de partículas de soluto y no de su naturaleza. Las cuatro propiedades coligativas principales son:
- Presión osmótica π=iCRT
- Aumento del punto de ebullición
- Disminución del punto de congelación
- Disminución de la presión de vapor
💡 ¡Dato clave! La osmolaridad determina si una solución es isotónica (igual concentración), hipotónica (menor concentración) o hipertónica (mayor concentración) respecto a otra, lo que afecta el movimiento del agua entre ellas.